Archives de Catégorie: Médecine
Un cœur artificiel en ferrofluide
Les ferrofluides sont des nanoparticules magnétiques en suspension dans un liquide (voir à ce sujet une œuvre d’art surprenante en ferrofluides : lien). Mais qui eut l’idée d’en faire profiter la médecine ? Des ingénieurs viennent de mettre au point une membrane contractile emplie de ferrofluides…
Leur invention pour le moins ingénieuse – quoi de plus normal pour des ingénieurs ! – se déforme sous l’action d’un champ magnétique, propulsant le sang à travers le circuit artériel.
L’objectif est d’imiter le myocarde (muscle cardiaque) tout en évitant l’implémentation de pièces mécaniques trop encombrantes donc contraignantes (moteur). Les ferrofluides agissent donc comme une véritable pompe… dénuée de moteur, l’énergie venant de l’extérieur, sous forme magnétique !
Source et vidéo : http://www.newscientist.com/blogs/nstv/2012/06/artificial-heart-ferrofluid-blood.html
Histoire succincte du diabète et de ses traitements
Tant l’histoire du diabète est pluridisciplinaire, elle mérite d’être contée : elle fait intervenir les chimistes, les biochimistes, les physiciens, les biologistes, les pharmaciens et bien sûr les médecins !
Pour réaliser ce bref exposé, je me suis basé sur un cours de l’Université Paris V Descartes, dûment vérifié avec plusieurs sources différentes.
Sa compréhension suppose connus les fondements du diabète : le diabète est une insuffisance pancréatique (aux causes multiples). La maladie est plus particulièrement due au dysfonctionnement des cellules bêta des îlots de Langerhans, structures du pancréas impliquées dans la sécrétion endocrine du pancréas (par opposition aux acini séreux déversant les sucs pancréatiques à destination de l’estomac via les canaux de Wirsung et Santorini).
Pour ce qui nous intéresse, le pancréas sécrète l’insuline (hormone hypoglycémiante) et le glucagon (hormone hyperglycémiante) : il joue donc un rôle primordial dans la régulation de la glycémie. Le diabète est une insuffisance partielle ou totale en insuline.
Ainsi, tout commence dans la haute Antiquité, puisque le papyrus d’Ebers (1460 av. J.-C. environ) mentionne les symptômes du diabète, en insistant sur la polyurie (uriner sans cesse). Les analyses sur la momie de la reine-pharaon Hatchepsout ont montré qu’elle était probablement atteinte de diabète.
En Inde, les médecins Susruta et Charaka remarquent les mouches et les fourmis sont attirées par l’urine de personnes atteintes d’un mal mystérieux, cause d’une soif intense (polydipsie). Le « madu mehe » (urine de miel) touche surtout les riches, en raison de leur consommation accrue de sucre.
En Chine, des livres de médecine vieux de 4000
On doit le mot « diabète » à Apollonius de Memphis, qui le forge en 250 av. J.-C. à partir des mots « dia » (à travers) et « betos » (fuite). En latin, diabetes signifie « siphon », étant donné que les malades ingèrent une grande quantité d’eau qu’ils éliminent presque aussitôt. Apollonius de Memphis interprète la maladie comme une production de fluide plus importante que ce que le malade peut absorber.
Au premier siècle de notre ère, Arétée de Cappadoce suppose la liquéfaction des chairs dans l’urine. En effet, les diabétiques deviennent rapidement squelettiques ; c’est un des symptômes de la maladie… Il note qu’après l’amaigrissement la mort survient vite, et que les reins et la vessie ne cessent d’émettre de l’urine. L’émission est profuse et n’a de limite que la mort !
Le célèbre médecin Claude Galien, exerçant à Pergame, décrit le diabète comme une maladie rénale vers 164.
Maïmonide s’impose comme le premier épidémiologiste du diabète. Ses conclusions sont en effet remarquables : « On voit peu de diabète en Europe, contient froid, alors qu’il est fréquent en Afrique, continent chaud. » Il note la grande proportion de diabétiques en Egypte, mais s’abuse néanmoins en supposant une origine climatique au diabète.
Pendant des siècles, médecins et goûteurs d’eau (sic) gouttent l’urine des patients diabétiques : le diagnostic repose sur le goût sucré de cette urine. Le diabète est alors nommé diabetes mellitus (diabète au goût de miel), terminologie toujours d’actualité (diabète sucré).
Au seizième siècle, le médecin Paracelse fait l’hypothèse de la corruption des humeurs (dans le cadre de la théorie des humeurs en vogue depuis Hippocrate). Pour lui, le diabète est une « combinaison inadaptée de soufre et de sel dans le sang ». Il voir une origine rénale au diabète (défaillance des reins), ce qui provoquerait une excrétion urinaire excessive. En chauffant l’urine des diabétiques, il obtient une poudre blanche (du sel) : et pour cause, la maladie agit comme un diurétique, en augmentant l’excrétion du chlorure de sodium, par l’urine. Il est également le premier à proposer le jeûne le plus complet aux diabétiques.
Thomas Willis (1621-1675) remarque que le diabète n’est pas une maladie rénale. Pour lui, c’est une maladie du sang, dont la partie aqueuse s’échappe dans l’urine. Il différencie surtout les diabètes : d’un côté le diabète sucré, de l’autre le diabète insipide.
Dans le même temps, le Bavarois Johann Georg Wirsung (1600-1643) étudie le pancréas. Il identifie le canal qui part du pancréas pour arriver dans l’intestin, et qui portera son nom par la suite…
Le médecin suisse Johann Conrad Brunner (1653-1727), est le premier à mentionner l’origine pancréatique du diabète. Après pancréatectomie de chiens, il observe en 1683 que les animaux ont une soif extrême et urinent fréquemment. Polyurie et polydipsie sont donc induites par l’ablation du pancréas.

« Experimenta Nova circa Pancreas. Accedit diatribe de lympha & genuino pancreatis usu. » est le premier ouvrage aux conclusions expérimentales sur l’origine pancréatique du diabète.
En 1776, Matthew Dobson obtient par évaporation de l’urine d’un diabétique une substance ressemblant au sucre roux (aspect et goût), mais les moyens de l’époque ne lui permettent pas de la caractériser précisément. Il est aussi le premier à donner une définition proche des diabètes de type I et II actuels, puisqu’il différencie le diabète : diabète chronique et diabète aigu, mortel.
Thomas Cawley, en 1788, publie dans le London Medical Journal une observation fort intéressante tirée d’une autopsie de diabétique : il note des lésions pancréatiques.
Frank Johann Peter (1745-1821), médecin allemand considéré comme un pionnier de la santé publique et de l’hygiène, a l’idée simple d’ajouter de la levure à l’urine des diabétiques pour détecter la présence de sucre : le dégagement gazeux produit par la fermentation signe la présence de sucre. Il établit, en outre, une classification des diabètes.
Le médecin écossais John Rollo (1750-1809), dans son livre An account of two cases of the Diabetes Mellitus paru en 1797, remarque l’odeur de pomme pourrie (plutôt type pomme verte en fait) de l’haleine des diabétiques. Pour lui, la maladie est d’origine stomachale : sécrétion exagérée de sucs gastriques. Aussi, il met en évidence le lien entre obésité et diabète, ainsi que la bienfaisance des régimes (ceux-ci réduisent la quantité d’urine). Il prescrit un régime à un patient obèse, le capitaine Meredith.
La chimie s’en mêle
Dupuytren et Thénard sont les premiers chimistes à supposer l’existence d’un quatrième sucre (le glucose !), présent uniquement dans l’urine des diabétiques. A l’époque, on ne connait que le sucre de fruit (fructose), le sucre de champignon (mannitol), ainsi que le « vrai » sucre (saccharose).
C’est Michel Eugène Chevreul qui, en 1815, identifie le glucose. Son article, Note sur le sucre de diabétique, paraît dans les Annales de Chimie.
La physique s’en mêle
Peu de temps après la découverte de Chevreul, Jean-Baptiste Biot établit avec le chimiste Jean-François Persoz les lois de rotation du plan de polarisation de la lumière.
En utilisant le pouvoir rotatoire du sucre, la voie est ouverte à la détermination de la concentration en sucre de l’urine des diabétique. En effet, l’angle de déviation de la lumière polarisée est proportionnel à la concentration d’une substance optiquement active. C’est ainsi qu’on va pouvoir mesurer (approximativement) la teneur en sucre de l’urine des malades. Le glucose est alors appelé dextrose, car il dévie à 52,7° la lumière polarisée vers la droite (dextrogyre).
En raison de la présence de quatre carbones asymétriques, le glucose est une molécule chirale, dont le stéréo-isomère naturel est le D-glucose. Bien qu’il existe un équilibre de tautomérisation, le β-D-glucopyranose est la forme majoritaire.

Le β-D-glucopyranose (ici en conformation chaise) est le conformère biologique du D-glucose, plus précisément l’anomère β (groupement OH vers le haut).

Projection de Fisher du D-glucose (le groupement OH le plus en bas est vers la droite, d’où D)
Grâce à ce nouvel instrument qu’est le saccharimètre, une relation entre glycémie (taux sanguin de glucose) et glycosurie (taux urinaire de glucose) est alors démontrée.
Dans son laboratoire de l’Hôtel-Dieu, à Paris, le pharmacien Apollinaire Bouchardat (1809-1866) s’en donne à cœur joie avec la chimie du sucre. A la même époque, en effet, de nombreux réactifs chimiques sont mis au point. En 1831, Becquerel entrevoit la curieuse propriété que possède le glucose de réduire l’oxyde cuivrique hydraté en donnant un précipité d’oxyde cuivreux. Le chimiste allemand Trommer signale en 1841 cette réaction à l’Académie des Sciences de Berlin. Le Français Charles-Louis-Arthur Barreswil (1817-1870), professeur de chimie à l’Ecole Turgot, améliore en peu de temps la découverte, qui lui vaut en 1844 le Prix de la Société pour l’Encouragement de l’Industrie Nationale. On trouvera des détails sur ce chimiste qui a fait beaucoup pour la médecine dans un article intitulé Charles-Louis-Arthur Barreswil et les sciences médicales : http://www.biusante.parisdescartes.fr/sfhm/hsm/HSMx1986x020x003/HSMx1986x020x003x0243.pdf
La réaction sus-citée est à la base d’un réactif ultra-connu des sucres : la liqueur de Fehling (élaborée par Hermann von Fehling). Il se trouve que le glucose est un aldohexose : il possède une fonction aldéhyde. Par conséquent, il réduit la liqueur de Fehling selon l’équation-bilan :
R-CHO + 2 Cu2+(aq) + 5 HO–(aq) → RCOO– + Cu2O(s) + 3 H2O
La formation d’un précipité rouge brique d’oxyde cuivreux permet de caractériser, entre autres, le glucose.
A l’Hotel-Dieu, Bouchardat mesure chaque jour la glycosurie des patients et concilie les résultats dans un carnet pour chaque patient : « cet essai de tous les jours est, pour la glycosurie, comme la boussole qui guide le navigateur sur des terres inconnues », écrit-il. Une glycosurie élevée est en effet signe de la gravité d’un diabète.
En 1839, le pharmacien publie un mémoire sur la nature et le traitement du diabète sucré. Il constate plus tard, en 1850, un affaiblissement de l’acuité visuelle chez les diabétiques (le diabète est aujourd’hui la première cause de cécité dans le monde).
Sa liste de symptômes du diabète est très complète :
– soif
– faim
– amaigrissement
– asthénie
– rétinopathie
– neuropathie
– gastroparésie
– troubles cardiaques
– troubles respiratoires (dyspnée, polypnée)
– altérations cutanées
– infections fréquentes
– problèmes bucco-dentaires
– troubles de la libido
– diminution de la fécondité
Une de ses remarques épidémiologiques provient de l’Histoire : lors du siège de Paris, dans le cadre de la Commune de 1870, Bouchardat remarque une amélioration des symptômes : la privation de nourriture est un facteur bénéfique pour les diabétiques. Il remarque qu’un mode de vie sain (ne pas manger trop sucré et pratiquer une activité physique régulière) permet de contenir un diabète, au point d’avoir une vie presque normale.
Pour Bouchardat, le diabète est une maladie insidieuse qu’il faut dépister le plus tôt possible. Il préconise un régime draconien : « vous ne guérirez qu’à condition de ne vous croire jamais guéri ».
Avec le Docteur Claude-Marie Stanislas Sandras, Bouchardat, qui a remarqué que le pain est l’ennemi numéro 1 des diabétiques, s’interroge sur la transformation de l’amidon ingéré en glucose.
On trouvera une biographie, assortie des travaux détaillés de Bouchardat ici : http://www.biusante.parisdescartes.fr/sfhm/hsm/HSMx2007x041x003/HSMx2007x041x003x0287.pdf (publiée dans la revue Histoire des Sciences médicales et rédigée notamment par le professeur François Chast, président de l’Académie Nationale de Pharmacie).
L’auteur souligne que depuis 1981 un prix Apollinaire Bouchardat est décerné par les diabétologues français, conférant une notoriété internationale au patronyme Bouchardat, pourtant peu connu au plan national.
On commence alors, dans les années 1850, à incriminer une diastase pancréatique, vieux terme signifiant enzyme.
« Dans le cas le plus simple, on peut admettre une exagération du ferment spécial sécrété par le pancréas », telle est une phrase prononcée à l’Académie des Sciences le 20 janvier 1845.
L’apport Claude Bernard (1813-1878)
Claude Bernard, médecin, physiologiste, membre de l’Académie Française et sénateur, est le fondateur de la médecine expérimentale, ainsi que le théoricien de l’homéostasie (maintien du milieu intérieur). En cela, il s’est beaucoup intéressé à la régulation hormonale.
Pour les biologistes de l’époque, les animaux – dont l’Homme – détruisent le sucre (du moins l’utilisent), mais ne peuvent pas en produire : c’est l’apanage des végétaux. Claude Bernard recherche l’origine de cette destruction : poumons, foie ?
Des années durant, Claude Bernard dose le sucre dans le sang prélevé à différentes parties de l’organisme, sur des animaux vivants ou fraîchement sacrifiés, certains nourris avec des glucides, d’autre à jeun ou nourris exclusivement de viande.
En 1848, il écrit une phrase tonitruante : « C’est à n’y rien comprendre ! » En effet, ses résultats expérimentaux ne sont pas conciliables avec l’idée d’une destruction du sucre par l’animal. Claude Bernard effectue en effets différents prélèvement, en amont et en aval du foi (c’est-à-dire dans la veine porte et dans la veine hépatique), et remarque que la concentration en glucose est supérieure en aval du foie, preuve que le foie synthétise du glucose (fonction aujourd’hui appelée glycogénolyse).
« C’est ce que nous pensons déjà connaître qui nous empêche souvent d’apprendre », note Claude Bernard.

Le glycogène, forme de stockage du sucre chez les animaux (équivalent de l’amidon végétal) est un polymère de glucose.
Il en conclut mot pour mot que « du sucre se forme dans le foie », et continue ses expériences. Selon que l’animal est suffisamment nourri ou non, Claude Bernard remarque que le foie synthétise plus ou moins de glucose. Il y a donc une régulation de la glycémie faisant intervenir le foie.
De ses études sur l’animal, puis chez l’Homme, Claude Bernard tire une conclusion remarquable : chez un sujet sain, la glycémie est indépendante de l’alimentation. Elle avoisine en effet le gramme par litre…
Leçons sur le diabète et la glycogenèse animale est consultable sur Gallica (BNF) : http://gallica.bnf.fr/ark:/12148/bpt6k77326m
Claude Bernard avait un mot d’ordre : « Pourquoi penser quand vous pouvez expérimenter ? Epuisez donc l’expérimentation et pensez ensuite ! » Il effectua notamment la célèbre expérience du foie lavé : trempez un foie dans l’eau, attendez un certain temps, et mesurez la concentration en sucre. Elle est positive… Lavez à nouveau le foie, attendez, mesurez la concentration en sucre : elle est positive !
Au fur et à mesure que le temps passe, du sucre est libéré par le foie. S’il ne l’est pas tout de suite, c’est que le sucre doit exister – et existe ! – sous une forme insoluble : le glycogène !
On sait aujourd’hui que la dégradation du glycogène est catalysée par la glycogène phosphorylase, codée par le gène PYGM situé au niveau du locus q13 du chromosome 11.
En 1869, à Berlin, se produit une révolution dans la diabétologie, qui passera pourtant inaperçue : Paul Langerhans, alors étudiant en médecine, publie ses travaux sur la structure microscopique du pancréas. Il y note deux systèmes imbriqués : un conglomérat cellulaire produit les sucs pancréatiques ; l’autre partie ressemble à un archipel : quelle est sa fonction ? Un jour, ces structures insulaires prendront le nom d’îlots de Langerhans. Si le mot « insulaire » ne vous évoque pas quelque chose…

Îlot de Langerhans (masse claire) baignant dans une mer d’acini séreux (masse violet foncé, sécrétant les sucs pancréatiques).
Cet exploit – distinguer les structures du pancréas – n’a été rendu possible que grâce aux colorants chimiques qui venaient d’êtrem is au point. Mais à quoi peuvent bien servir les îlots de Langerhans ? Nul ne le sait alors !
Dans les années 1880, le colorimètre de Duboscq (ancêtre du spectrophotomètre) est mis au point par Louis Jules Duboscq (1817-1886). Se basant sur la loi de Beer-Lambert, qui relie la concentration d’une espèce en solution à son absorbance lumineuse, ce dispositif permet d’affiner les mesures du saccharimètre.

On dispose l’échantillon (comme l’urine, ou un distillat d’urine) dans des cuves. L’atténuation d’un faisceau lumineux traversant la solution renseigne sur la concentration en glucose.
Cependant, au dix-neuvième siècle, les analyses chimiques sont longues. Elles nécessitent de purifier l’urine, en faisant par exemple appel à des méthodes de cristallisation fractionnée. On n’en est pas à l’analyseur multiparamétrique à haut débit des années 2000…
Etienne Lancereaux (1829-1910) défend l’origine pancréatique du diabète, en introduisant le terme de « diabète pancréatique ». Il publie en 1888 diverses preuves de l’implication du pancréas dans le diabète. Un an plus tard, le Docteur Oskar Minkowski (frère du mathématicien et physicien Hermann Minkowski et père de l’astronome Rudolph Minkowski), ainsi que le physicien Joseph Von Mering, travaillant tous deux à l’Université de Strasbourg confirment l’hypothèse de Lancereaux.
En 1890, Lindsay Opie (1873-1971) pense que le diabète est dû à la destruction des îlots de Langerhans.
Marcel Eugène Gley (1857-1930) est alors un pionnier en son genre : dès 1891, il prépare des extraits de pancréas destinés à soigner le diabète, mais abandonne ses recherches prématurément pour se consacrer au professorat au Collège de France.
A l’aube du vingtième siècle, on ne dispose toutefois d’aucun traitement contre le diabète, si ce n’est la prévention !
La révolution du vingtième siècle : l’insuline
Le pathologiste Carl Von Noorden (1858-1944) découvre, ou plutôt formalise la diététique dans le traitement du diabète. Il recommande en particulier de consommer de l’avoine, et peu de pommes de terre. La cétose, diète faible en glucides, est recommandable aux diabétiques ; toutefois elle doit être modérée, au risque de conduire à l’acidocétose (production néfaste de corps cétoniques par l’organisme), d’autant que nous savons aujourd’hui que le déficit en insuline conduit, par l’intermédiaire du glucagon, à la cétogénèse (voie alternative de consommation de l’acétyl-coenzyme A). Mais n’allons pas trop vite…
Au début du vingtième siècle, les seuls traitements contre le diabète, sont ce qu’on appelerait aujourd’hui des médicaments homéopathiques, c’est-à-dire des boissons à base de plantes dont l’efficacité n’est pas démontrée. Pour autant, le quinquina augmente les forces, les opiacés coupent l’appétit et les solanées diminuent la glycosurie. Bien entendu, aucun de ces traitements n’est réellement curatif, mais ils soulagent légèrement les symptômes du diabète.
En 1906, le pathologiste Bernhard Naunyn (1839-1925) introduit la notion d’acidocétose diabétique (cétogénèse consécutive aux carences en insuline). La respiration difficile des patients en acideocétose a déjà été décrite par Adolf Kussmaüll en 1874.
Le Docteur Frederick Madison Allen est sans doute l’un des plus grands diabétologistes du vingtième siècle. En 1919, il publie Total Dietary Regulation in the Treatment of Diabetes. Pour lui, l’opothérapie (injection d’hormones, ou extraits animaux) est nécessaire, d’autant qu’en 1853 Alexander Wood a mis au point la seringue, telle qu’on la connaît aujourd’hui. Allen soutient que ce n’est pas la production de sucre endogène qui pose problème dans le diabète, ni même l’absorption intestinale. Il devient directeur de l’unité de diabétologie du Rockefeller Institute en 1920.
Le Docteur Elliott P. Joslin (1869-1962) est cependant le premier diabétologue reconnu, au sens où il est médecin spécialiste du diabète. Il est le fondateur du Joslin’s Diabete Center de Boston, qui existe toujours. Mais surtout, Joslin milite pour l’éducation thérapeutique des patients : pour vivre avec leur diabète, les patients doivent être informés du régime adéquat. En plus d’écrire un manuel d’éducation à visée du malade diabétique, Joslin développe surtout les sois infirmiers (la wandering nurse).
Jusque dans les années 1920, cependant, le diabète reste une maladie dévastatrice… Retour en arrière en 1906 : Georg Ludwig Zuelzer met au point l’Acomatrol, extrait de pancréas plus ou moins purifié. Il en injecte à un diabétique mourant qui, après une amélioration transitoire, meurt. Il dépose un brevet aux USA, mais en Allemagne ses résultats sont modestes et les autorités ferment sont laboratoire.
En août 1921, le professeur de médecine roumain Nicolae Paulesco montre que chez un chien pancréatectomisé, l’injection intraveineuse d’un extrait pancréatique (appelé Pancréine, et alors purifié avec de la soude et de l’acide chlorhydrique) provoque une diminution notable de l’hyperglycémie, pouvant aller jusqu’à l’hypoglycémie. Il décrit la durée d’action brève du traitement, et en raison de l’irritation locale lors de l’injection, est contraint d’abandonner l’idée d’un essai chez l’Homme.
La révolution aura lieu au laboratoire de John J. R. Macleod : parti en vacances, il laisse les clefs de son laboratoire à l’un de ses plus brillants étudiants, Charles Best, ainsi qu’à Frederick G. Banting.
La clé du problème
En octobre 1920, Banting lit un article de Moses Barron (1911-1978) de l’Université du Minnesota décrivant une pancréatite (infection du pancréas) ayant détruit les acinus séreux, mais laissant intacts les îlots de Langerhans, situation identique à la ligature des canaux pancréatiques.
Dès lors, Banting prépare un extrait de pancréas sans interaction avec les sucs pancréatiques : la trypsine qu’ils contiennent digèrent une éventuelle substance active des îlots de Langerhans. De plus, la trypsine active par clivage une proenzyme : le chymotrypsinogène, devenant alors la chymotrypsine, une protéase.
L’été 1921, Banting et Best connaissent leur premier succès : l’injection d’extraits d’îlots de Langerhans, et non plus de pancréas entièrement, augmente la durée de vie de chiens pancréatectomisés.

Banting (à droite) et Best (à gauche) posent avec Marjorie, chienne qui survira 70 jours sans pancréas !
Le 30 décembre 1921, Banting présente une conférence à l’Université de Yale, intitulée The beneficial influences of certain pancreatic extracts on pancreatic diabetes. Remarquez bien le « certains » extraits !
Intervient alors le biochimiste James B. Collip. Il évalue la puissance des préparations par l’abaissement de la glycémie du lapin non diabétique.
En janvier 1922, il remarque de l’extrait pancréatique purifié contient un agent antidiabétique. Cet agent est non toxique et permet à un chien diabétique d’abaisser considérablement sa glycémie. L’agent en question est nommé isletin, car islet signifie îlot (de Langerhans !) en anglais. Collip note toutefois la puissance extraordinaire de cet agent, pouvant s’avérer dangereuse : chez le lapin, l’injection d’extraits pancréatiques peut provoquer une hypoglycémie s’assortissant de convulsions !
C’est en avril 1922 que l’insuline acquiert son nom actuel. Entre temps, des dizaines d’essais cliniques ont été effectués, presque tous avec succès. Si l’injection d’insuline provoque des hypoglycémies mortelles, elle n’en reste pas moins, au printemps 1922, un traitement-miracle.
Dans le même temps, Banting et Best procèdent à la première injection chez l’être humain : le 11 janvier 1922, injection de 7,5 mL d’une « épaisse boue brune » (sic) à Leonard Thomson, diabétique de 14 ans mal en point. Des abcès se forment ; le lendemain al glycémie baisse modérément. Son état se dégrade alors, et étant donné que les doses sont mal connues, ainsi que l’écart entre deux injections, Banting et Best sont contraints d’arrêter net l’essai.
Macleod et Collip sont furieux de cet essai qu’ils jugent trop précoce. Une deuxième injection a lieu le 23 janvier : Collip a amélioré la préparation destinée au jeune Leonard. Cette fois, c’est un succès ! La glycémie baisse de 5,2 à 1,2 g/L. Les deux jours suivant, les chercheurs ne procèdent à aucun essai et la glycémie remonte alors. Dans les semaines qui suivent, Leonard Thomson subit une administration quotidienne, et reprend alors du poids et des forces. Leonard Thomson, premier patient traité à une molécule qui n’est autre que l’insuline, vivra treize années supplémentaires, en assez bonne santé (il meurt d’une pneumonie).
La première publication sur les effets de l’insuline dans le traitement du diabète a lieu en février 1922 dans The Journal of Laboratory and Clinical Medicine. Comme le traitement est révolutionnaire, les premiers lots sont fabriqués dès le mois d’avril par l’Université de Toronto. Les premiers flacons d’insuline ont une teneur en principe actif de 10 UI/mL (contre 100 UI/mL en 2000 !) mais s’avèrent efficaces ; cependant ils sont vite remplacés par des flacons à 40 UI/mL, dépourvus d’effets secondaires trop gênants. On précise que 1 UI (Unité Internationale) d’insuline est l’équivalent biologique d’environ 45,5 microgrammes : pour agir, il faut des quantités relativement importantes d’insuline.

Teddy Ryder fut l’un des premiers patients traités à l’insuline : il devint un petit garçon joufflu qui retrouva sa joie de vivre !
L’un des tous premiers patients traités à l’insuline est Elizabeth Hughes Gossett, la fille du Gouverneur de New York. Est ensuite traité le futur artiste James D. Havens : le Dr John Ralston Williams importe l’insulinr depuis Toronto jusqu’à Rochester (Etat de New York) pour traiter Havens.
Triste histoire pour Charles Best, découvreur de génie : le Prix Nobel de médecine 1923 fut décerné à John Macleod et Frederick Banting. L’Institut Karolinska a dû le juger trop jeune, mais il n’y a pas d’âge pour sauver des millions de gens !
La suite de l’histoire
L’histoire ne s’arrête pas là pour autant ! Reste à comprendre l’origine du diabète et le mode d’action, ainsi que la structure de l’insuline.
John Jacob Abel enseigne la pharmacologie à l’Université John Hopkins (Baltimore) de 1893 à 1932. Il y poursuit ses recherches jusqu’en 1938, car pour lui la chimie permet d’expliquer la médecine. Son objectif est d’isoler et de purifier des hormones, telle l’adrénaline, mais aussi l’insuline, justement. En 1926, Abel obtient une insuline cristallisée. C’est alors la première protéine purifiée. La brièveté de la durée d’action conduit à de nombreuses réflexions sur la pharmacocinétique de l’insuline.

Cristaux d’insuline.
Afin d’éviter les injections répétées, l’objet de la recherche biomédicale des années 1930 est de prolonger la durée d’action de l’insuline. Pour cela, il faut comprendre sa structure. Or, à cette époque, on ne sait pas de quoi est fait une protéine !
Le Docteur Hans Christian Hagedorn obtient les droits sur l’insuline, au Canada : il fonde en 1923 l’une des plus grandes entreprises spécialisées dans les soins aux diabétiques : Nordisk Insulinlaboratorium (aujourd’hui Novo Nordisk, basé au Danemark). Mais il n’est pas seul : le chimiste A. Kongsted prend part au projet ainsi qu’August Krogh, qui, en 1920, a reçu le prix Nobel de physiologie ou médecine « pour sa découverte du mécanisme de régulation moteur des capillaires« . Il a également défini la constante de Krogh (produit du coefficient de diffusion d’un gaz avec sa capacitance).
En 1936, la NPH (Neutral Protamine Hagedorn) est préparée par additions de protamines à l’insuline. Cette préparation sera remplacée en 1952 par l’insuline lente, préparée avec du zinc.
Frederick Sanger est le biochimiste qui va révolutionner le séquençage des protéines (et pas seulement que des protéines d’ailleurs, puisqu’il met au point la méthode de séquençage de l’ADN qui porte son nom). Sanger est l’un des rares à avoir reçu deux fois le Prix Nobel de chimie : une fois en 1958 « pour son travail sur la structure des protéines, particulièrement celle de l’insuline, l’autre en 1980 avec Walter Gilbert » pour leurs contributions à la détermination des séquences de base dans les acides nucléiques ».
En fait, le séquençage d’un protéine est plus difficile que celui de l’ADN. Dans son discours du Prix Nobel de 1958, Sanger explique : « Les résultats […] indiquent que les protéines sont des substances chimiques définies, qui possèdent une structure unique dans laquelle chaque position de la chaîne est occupée par un, et un seul, résidu d’acide aminé ». A cette époque, on ne connaît pas bien la structure des protéines, en effet !
En 1955, il parvient pourtant à séquencer l’insuline, cette prouesse étant à l’origine de la bioinformatique.
On sait aujourd’hui qu’une protéine est un assemblage d’acides aminés liés entre eux par des liaisons peptidiques. La liaison peptidique est une liaison covalente qui s’établit entre la fonction carboxyle portée par le carbone α d’un acide aminé et la fonction amine portée par le carbone α de l’acide aminé suivant dans la chaîne peptidique. Elle correspond à une fonction amide dans le cas particulier des macromolécules biologiques.

Formation d’une liaison peptidique, liant entre eux les acides aminés constitutifs d’une protéine.
Reste à résoudre la structure de l’insuline. Comme toutes les protéines, elle se caractérise par un agencement d’acides aminés dans un certain ordre (structure primaire) :
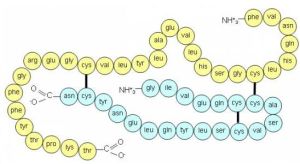
Séquence en acides aminés de l’insuline humaine. Celle-ci se compose d’une chaîne A de 21 acides aminés et une chaîne B de 30 acides aminés.
Le séquençage d’une protéine se dit de la résolution de sa structure primaire. C’est chose faite en 1955, grâce à la chromatographie bidimensionnelle mais la partie est loin d’être terminée !
La structure secondaire définit le repliement local d’une chaîne polypeptidique.
La structure tertiaire, ou repliement tridimensionnel des chaînes polypeptidiques, confère à une protéine son activité (en particulier un site actif dans le cas des enzymes).

Schéma de la structure tridimensionnelle de la myoglobine. Les hélices α, reliées par des coudes, sont indiquées en couleur. Les régions en pelote aléatoire sont en blanc.
Concernant la structure quaternaire (nombre de chaînes polypeptidiques), on sait aujourd’hui que l’insuline est une protéine dimérique : elle possède deux sous-unités.
La voici donc… Sa forme active se compose de deux chaînes polypeptidiques reliées par des ponts disulfure, mais elle est stockée sous forme hexamérique (agrégat de trois molécules d’insuline à deux chaînes).

Hexamère d’insuline : l’insuline est stockée dans le pancréas sous cette forme (un ion zinc, en violet assure la stabilité).
Entre temps, la biologie structurale s’est enrichie de nombreuses méthodes d’élucidation, comme la diffractométrie des rayons X ou la Résonnance Magnétique Nucléaire (RMN), ou encore la cryo-microscopie.
En 1902, Nicholls décrit une tumeur des îlots de Langerhans.
En 1927, Wilder enlève chirurgicalement un insulinome.
En 1938, George Laidlaw définit la nésidioblastose du pancréas : il s’agit d’une tumeur des îlots de Langerhans, cause d’hyperinsulinisme famililial (due à une mutation du gène KCNJ11).
Mode d’action de l’insuline
L’insuline est produite par les cellules β des îlots de Langerhans du pancréas sous la forme d’une pré-pro-insuline constituée d’une seule chaîne peptidique, dont un fragment, le peptide signal (23 acides aminés à l’extrémité N-terminale) est éliminé : on obtient la pro-insuline qui subit l’élimination du peptide C (découvert en 1967) pour devenir l’insuline (forme active).
Le peptide C est un peptide (polymère d’acide aminés) de connexion. La différence entre peptide et protéine provient du fait que les peptides ne subissent ni repliement protéique, ni modification post-traductionnelle.
La proinsuline a une structure très voisine de celle des deux principaux facteurs de croissance, IGF-1 et IGF-2, et des concentrations élevées de ces hormones permettent des effets biologiques par signalisation après liaison aux récepteurs similaires : hypoglycémie lors de sécrétion massive d’IGF-1 et d’IGF-2 par des tumeurs.
L’insuline agit en se liant à des récepteurs à l’insuline, principalement situés au niveau du foie, ce qui déclenche la glycogénogenèse, et abaisse ainsi la glycémie.
Le récepteur à l’insuline est un récepteur tyrosine kinase. C’est un homodimère (association de deux chaînes polypeptidiques identiques). Lorsque le ligand (l’insuline !) se fixe sur son récepteur, celui-ci s’autodimérise (par des interactions secondaires, il y a une association de deux mêmes protéines bitopiques de type I). Du côté intracellulaire, ceci provoque l’autophosphorylation croisée du récepteur (ou transphosphorylation). Sous forme homodimérique, le récepteur se phosphoryle de part et d’autre sur ses deux sous-unités, par modification conformationnelle successive et ce, exclusivement sur ses résidus tyrosine issus de domaines qui en sont riches. Pour chaque résidu tyrosine phosphorylé, il y a une molécule d’ATP consommée. Cette phosphorylation permet d’une part d’accroître l’activité enzymatique du récepteur sur son site catalytique (qui n’a pas de relation directe avec la transduction du signal) et d’autre part, de libérer des sites à haute affinité pour des protéines de signalisation : des enzymes ou bien des protéines adaptatrices. Le signal de transduction prolifère par l’interaction du site d’affinité du récepteur et des protéines qui s’y associent.
La voie de transduction du récepteur à l’insuline est extrêmement complexe, mais très bien connue. Voir un cours de l’Université Pierre et Marie Curie (Paris) : http://www.chups.jussieu.fr/polys/biochimie/MIbioch/POLY.Chp.4.2.html
Le glucose sanguin filtre à travers le capillaire dans la lymphe interstitielle qui baigne les cellules β des îlots de Langerhans. La concentration de glucose autour des cellules β est donc la même que dans le sang. La cellule importe le glucose par un transporteur non saturable GLUT2 (les autres cellules du corps ont un récepteur rapidement saturé). La concentration de glucose intracellulaire reflète donc celle du sang. L’entrée du glucose dans la cellule bêta est immédiatement suivie de sa phosphorylation par une hexokinase spécifique, la glucokinase, dont les caractéristiques cinétiques jouent un rôle important dans le couplage glycémie/insulinosécrétion (la perte de 50 % de l’activité de la glucokinase est la cause d’une forme particulière de diabète, le MODY-2). Le métabolisme du glucose dans la cellule β augmente le rapport ATP/ADP. Cela induit la fermeture d’un canal potassique sensible à cette augmentation de la quantité d’ATP. Si les ions potassium cessent de sortir cela dépolarise la cellule β qui est une cellule excitable, puisqu’elle a une activité électrique dès que les concentrations en glucose extracellulaire dépassent 5 mmol/L. Cette dépolarisation ouvre des canaux calciques sensibles au voltage : le calcium entre dans la cellule et déclenche l’exocytose des vésicules contenant de l’insuline.
L’insuline recombinante : une révolution
La première insuline synthétique est produite simultanément dans le laboratoire de Panayotis Katsoyannis à l’Université de Pittsburgh, et par Helmut Zahn à l’Université RWTH d’Aix-la-Chapelle en 1965. Elle l’est cependant en très faible quantité.
En 1978, le génie génétique prend son envol : Herbert Boyer parvient à transférer le gène de l’insuline humaine dans l’ADN d’Escherichia coli. C’est l’une des premières transfections réalisées avec succès, et Boyer cofonde avec Robert A. Swanson la société Genentech, première entreprise de biotechnologies. En 2009, elle est vendue 47 milliards de dollars à Roche, tant l’insuline recombinante a révolutionné le traitement du diabète. En effet, l’insuline animale, principalement issue de porc, n’est pas exactement la même que l’insuline humaine : elle n’est donc pas aussi efficace, et demande de sacrifier des millions de porcs pour pourvoir à la demande.
En 1960, Yalow et Berson découvrent la méthode radio-immunologique pour le dosage de l’insuline et démontrent que les impuretés étaient responsables des réactions allergiques et de la formation d’anticorps contre l’insuline.
En 1970, l’élimination de ces impuretés donne des insulines purifiées, appelées Monopic ou Monocomposées.
En 1982, Eli Lilly and Company, en partenariat avec Genentech, met sur le marché la première insuline réalisée par biosynthèse, sous le nom de marque Humulin.
Jusqu’à ce que des bactéries synthétisent l’insuline en grande quantité, des patients mouraient encore d’hyperglycémie ; aujourd’hui l’hyperglycémie associée au diabète n’est, toutes proportions gardées, plus un problème en soi : ce sont les complications qui sont les plus préoccupantes.
En 1990, des analogues synthétiques de l’insuline à action prolongée voient le jour.
Glucomètre et injection d’insuline
Etant donné la recrudescence du diabète insulinodépendant, il devint impossible de procéder à l’injection d’insuline en milieu médicalisé.
En 1961, Becton-Dickinson met sur le marché la seringue à usage unique, destinée aux diabétiques.
En 1966, Holdrege, basée au Nebraska, ouvre la plus grande usine de seringues à insuline dans le monde.
En 1979, le système Derma-Ject est mis sur le marché. Développé par The Derata Corporation, il ne comporte pas d’aiguille.
En 1985, le stylo Novopen, développé par Novo Nordisk, est disponible.
En 2000, le lecteur portable de glycémie fait son apparition : il suffit de se piquer le bout du doigt et de lire sa glycémie. Il a depuis été perfectionné…

Le lecteur de glycémie Beurer est un lecteur de dernière génération : il comporte une interface USB et est muni d’un logiciel de suivi de la glycémie.
En fait, le lecteur de glycémie date du début des années 1980, mais il s’agissait au départ d’un procédé colorimétrique assez long, qui consistait à déposer une goutte de sang sur une bandelette, rincer la bandelette avant réaction du sucre avec un composé réducteur générant un composé coloré… Le principe n’est pas grandement différent de celui du papier pH, bien moins pratique et précis qu’un pH-mètre, d’autant que Glucometer – c’est le nom du premier appareil – devait être étalonné.
La pompe à insuline
La pompe à insuline est un dispositif de délivrance d’insuline à débit variable. Elle s’utilise dans les cas de diabète les plus sévères nécessitant une délivrance continue d’insuline.

La pompe à insuline est un dispositif électronique assurant automatiquement la perfusion en insuline.
Traitements classiques
L’innovation véritable dans le traitement du diabète provient de la conception de médicaments dits sécrétaguogues : plutôt qu’injecter de l’insuline, ne pourrait-on pas forcer le pancréas à en sécréter ?
En 1942, Marcel Janbon découvre l’action antiinfectieuse des sulfamides. Néanmoins, ceux-ci provoquent une hypoglycémie majeure : certains patients tombent même dans le coma. Auguste Loubatières, physiologiste, vérifie expérimentalement la baisse prolongée de la glycémie. Il démontre qu’avec une action dose-dépendante les sulfamides stimulent la sécrétion d’insuline.
Voici ce qu’il écrit : « A notre avis, le para-amino-benzène-sulfamido-isopylthiodiazol (2254 RP) est un corps essentiellement insulino-sécréteur ; action directe sur les îlots de Langerhans ».
Lire l’histoire complète de la découverte des sulfamides hypoglycémiants ici : http://www.biusante.parisdescartes.fr/sfhm/hsm/HSMx1985x019x001/HSMx1985x019x001x0055.pdf
Les sulfamides ont longtemps été les seuls médicaments disponibles, complémentaires de l’insulinothérapie. De nos jours, les méglitinides, les analogues du GLP1, ainsi que les inhibiteurs du DPP4 sont des médicaments antidiabétiques courants favorisant la sécrétion d’insuline.
Les glinides, dont le chef de file est le répaglinide, mis sur le marché en 1998, renforcent la réponse insulinique lors des repas, en agissant de façon semblable aux sulfamides.
Nouveaux traitements
Le GLP-1 (Glucagon Like Peptide 1), ainsi que GIP sont des hormones gastro-intestinales favorisant la sécrétion d’insuline lorsque la glycémie est trop élevée : on les appelles incrétines. Récemment, leur étude permit la conception des incrétinomimétiques, telles l’exénatide, analogue du GLP-1.

Séquence de l’exénatide, une protéine.
En 1992, le Docteur John Eng isole l’exendine-4 dans la salive du monstre de Gila. L’exénatide est un peptide de 39 acides aminés, analogue synthétique de l’exendine-4. Le liraglutide est une substance voisine.
En plus de son action incrétinomimétique, l’exénatide diminue le taux sanguin de ghréline, hormone stimulant l’appétit, ce qui est souhaitable dans le diabète.
Or, l’enzyme dipeptidyl-peptidase 4 (DPP4) dégrade rapidement les incrétines ; d’où la conception d’inhibiteurs de la DPP4, encore appelés gliptines (sitagliptine, vildagliptine, saxagliptine).
D’autres médicaments potentialisent l’action de l’insuline. C’est le cas de la metformine et des thiazolidinediones. Sans oublier les biguanides…
Galega officinalis est une plante utilisée dans la médecine traditionnelle depuis des siècles. Ses graines contiennent un alcaloïde, la galégine, découvert par Charles Tanret en 1914. L’oxydation de la guanine mène à la guanidine, composé cristallin actif dans le traitement du diabète, mais retiré du marché dès 1932 en raison de son hépatotoxicité (c’est un agent chaotropique : elle dénature les protéines et l’ADN !)

m Fleur de Galéga officinal.
Les synthalines A et B ont également été reléguées avec le développement de l’insuline.

Formule topologique de la guanidine.
La metformine a été décrite en 1922 par Emil Werner et James Bell : il s’agit de diméthylguanidine, preuve qu’il ne faut pas jeter un médicament aux oubliettes trop vite…
La phenformine est retirée du marché en 1978 pour risque d’acidose métabolique, mais la metformine est toujours le pilier de la prise en charge du diabète de type II. C’est un médicament normoglycémiant, c’est-à-dire qu’elle agit sur la sensibilité des tissus à l’insuline. Son mécanisme d’action n’est pas encore totalement élucidé…
Les inhibiteurs des alpha-glucosidases agissent en diminuant l’absorption intestinale de sucres.
Les thiazolidinediones, encore appelées glitazones, sont les médicaments les plus récents. Ils agissent par liaison aux récepteurs activés par les proliférateurs de peroxysomes, récepteurs nucléaires et jouent également sur la sensibilité tissulaire à l’insuline. Leur développement remonte au début des années 1980, par les Japonais Hiroshi Imoto (laboratoire pharmaceutique Takeda d’Osaka) et Takashi Sohda (Université de Fukuoka). A noter que trois de ces médicaments ont été retirés du marché : le rosiglitazone est cardiotoxique, le troglitazone hépatotoxique, et le pioglitazone a été suspendu en 2011 pour suspection de cystotoxicité.
NB : cette liste d’antidiabétiques oraux n’est pas exhaustive.
Mode d’action des incrétines
Les incrétines font intervenir des récepteurs couplés aux protéines G. La voie de transduction du signal est semblable à celle des récepteurs muscariniques, aux prostaglandines et leucotriènes : à savoir fixation du ligand => activation de la protéine G => activation de l’adénylate cyclase ou de la phospholipase C. Une cascade de réactions est alors déclenchée, en particulier la conversion d’AMP cyclique en ATP conduit à l’activation de la phosphokinase A, mais aussi le diacylglycérol (DAG) conduit à l’activation de la phosphokinase C, et l’ionositol triphosphate (IP 3) induit en se fixant sur la membrane du réticulum endoplasmique la libération d’ions calcium dans le cytosol.
L’ionositol triphosphate et et le diacylglycérol proviennent du clivage du phosphatidylinositol en réaction à la stimulation hormonale.
La voie de transduction des incrétines fait intervenir les beta-arrestine 1 et 2, très étudiées de nos jours.
Cette étape complexe passe par un premier changement de conformation des beta-arrestines qui adoptent une conformation ouverte « active » en se liant aux RCPG à la membrane plasmique. Lors de ce changement de conformation, la région C-terminale est libérée des domaines globulaires démasquant ainsi des sites de liaison à la clathrine et au complexe AP-2 qui permettent l’adressage des complexes beta-arrestine/RCPG.
Vers le pancréas artificiel
Les recherches actuelles, en dehors de la greffe d’îlots de Langerhans, se concentrent sur la conception d’un pancréas artificiel. L’idée est de mimer le servomécanisme à l’œuvre dans la régulation naturelle de la glycémie. En effet, les cellules bêta des îlots de Langerhans se composent d’une partie réceptrice (analysant la glycémie) et d’une partie effectrice (produisant l’insuline en fonction de la glycémie). L’enjeu est d’adapter cette rétro-action au sein d’une puce à insuline.
Voir l’interview d’Alain Ducardonnet, diabétologue au CHU de Montpellier : http://videos.tf1.fr/infos/lci-sante/pancreas-artificiel-un-grand-espoir-pour-les-diabetiques-6819049.html
La greffe d’îlots est réussie par James Shapiro en 2000
En plus de l’insuline (cellules beta) et du glucagon (cellules alpha), le pancréas endocrine sécrète la somatostatine (cellules delta), ainsi que le polypeptide pancréatique (cellules F).
Il se passe donc plein de choses dans les îlots de Langerhans ! La découverte de ces hormones dans le pancréas a été rendue possible par l’immunofluorescence, technique de marquage utilisant des anticorps couplés à des fluorochromes. En effet, ces hormones-ci étant noyées dans la masse d’insuline et de glucagon, les colorations de routine ne permettent pas de les détecter.
Or la somatostatine pancréatique permet, en outre, de moduler la sécrétion d’insuline.
La compréhension parfaite du fonctionnement des îlots de Langerhans est nécessaire pour mettre au point des traitements antidiabétiques novateurs, ou (plus vraissemblablement ?) pour palier à un pancréas défaillant par un implant.
L’amour médicament
Il ne s’agit pas d’ajouter des années à la vie, mais de la vie aux années.
En terme de bien-être, la médecine fondée sur les faits (plus connue sous son acronyme anglais EBM pour evidence based medicine), fait des ravages : elle substitue la démarche expérimentale (hypothèse, expérience, conclusion) à notre inhérente subjectivité.
En clair ? L’EBM, ce sont des médecins qui n’en peuvent plus pour leur blouse blanche. Cette pratique représente les médecins qui ne jurent que par les statistiques et par la pharmacologie, sans oublier leur stéthoscope, en négligeant notre humanité. Ils pourraient ignorer le nom de leur patient ; ça ne changerait pas grand chose au traitement.
Idéalement, la biophysique, la chimie et la biologie cellulaire sont complémentaires à une prise en charge basée sur l’affect ; elles ne peuvent monopoliser l’attention du praticien. Si le rôle d’un médecin est avant tout de soigner, il se doit d’écouter le patient, et pas seulement ses symptômes. Les sciences fondamentales sont au service de la médecine, certes, mais la médecine ne doit pas se réduire aux sciences fondamentales, au risque d’augmenter la quantité de vie sans se soucier de la qualité de vie. Actuellement les sciences fondamentales desservent la médecine sans doute autant qu’elle ne la servent : avec l’avènement irréfléchi de l’EBM, le médecin devient un robot qui intègre des plaintes en entrée et prescrit un traitement à la sortie, souvent en quelques minutes, sans se pencher sur la personnalité du patient. Bref, dans le cadre de la tarification à l’activité, faute de temps, les médecins sont trop chirurgiens et pas assez psychiatres : c’est la médecine à la chaîne.
Hippocrate disait « Guérir parfois, soulager souvent, écouter toujours » !
Je rappelle aussi l’effet placebo et l’effet Hawthorne, désignant respectivement la guérison d’un patient parce qu’il croit qu’il est soigné (alors qu’on lui donne un bonbon), et la guérison du patient parce qu’il a conscience qu’on tient à le soigner (donc il est plus motivé à se soigner).
Face au rationalisme scientifique outre-mesure, l’amour vaut bien des médicaments :
Il l’a fait : s’opérer lui-même !
L’histoire remonte à 1961. Leonid Rogozov, 27 ans, était le seul chirurgien d’une expédition soviétique en Antarctique. Pas de pot, il eut terriblement mal au ventre et de la fièvre. En s’examinant, il se découvrit une appendicite. Sous anesthésie locale, il procéda lui-même à une appendicectomie : en cette contrée reculée, c’était cela ou la mort. Pour seul assistant un météorologue, l’opération d’une heure et demi fut un succès : Rogozov mourut en 2000 !
Le miel : un antibiotique surpuissant !
Après le roquefort, voici le miel ! Précieux trésor des abeilles, nectar au prix d’or, le miel est doté de vertus antibiotiques incomparables, mais aussi de propriétés cicatrisantes qui fascinent les scientifiques.
Mais d’où vient le miel ?
Le miel est la production des glandes mandibulaires et hypopharyngiennes des abeilles. Il provient du nectar, liquide sucré sécrété par les plantes, et que les abeilles adorent butiner. Selon les fleurs, le miel possède une saveur différente : on retrouve du miel de sapin des Vosges, de romarin, d’acacia, d’Alsace, de Provence, mille-fleurs… Certains miels sont évidemment plus réputés que d’autres, mais tous sont à peu près aussi bon pour la santé ; l’idéal étant de se diversifier, de ne pas toujours goûter au même !
A quoi sert le miel ?
En dehors de régaler nos papilles, le miel est destiné aux abeilles qui l’entreposent dans leur ruche et le consomment tout au long de l’année, en particulier lors de conditions climatiques défavorables pour trouver de la nourriture. Bien entendu, dans les fermes apicoles, les abeilles sont nourries en échange de leur miel. Au passage, certains animaux raffolent également de miel : la légende de l’ours acharné à attraper la ruche est plus qu’une légende !
Le miel : un tonifiant
Les Romaines et les Grecques prenaient des bains au lait, mais elles s’enduisaient également le visage de miel dans leur bain ! Pour cause, le miel assouplit la peau et la nourrit grâce à de nombreux composés chimiques. Ceci dit, étant donné sa raréfaction – et par conséquent son prix de plus en plus inabordable – il serait dommage de « gâcher » le miel. Si les élégantes de l’Antiquité pouvaient se le permettre, c’est qu’on en disposait autrefois à profusion, alors qu’aujourd’hui les abeilles sont en voie de disparition.
Le miel comme antibiotique
Le miel s’illustre comme l’un des antibiotiques naturels les plus puissants. Ainsi, toutes les espèces testées, incluant des bactéries impliquées dans des intoxications alimentaires, comme Bacillus subtilis ou Escherichia coli résistante à plusieurs antibiotiques, ou dans des infections nosocomiales, comme Staphylococcus aureus (staphylocoque doré) résistante à la méticilline, Pseudomonas aeruginosa résistante à la ciprofloxacine et Enterococcus faecium résistante à la vancomycine ont toutes été tuées par seulement 10 à 20% de miel (1 ou 2 millilitres de miel dans 10 millilitres de bactéries), ou par 40% de sucre extrait du miel. Ce test indique que l’antibiotique contenu dans le miel est efficace sur beaucoup de souches bactériennes, même déjà résistantes. Il aura fallu attendre 2010 pour mettre en évidence dans le miel des défensines, protéines présentes dans l’hémolymphe (équivalent du sang chez les insectes) et jouant un rôle crucial dans le système immunitaire des abeilles. Comme nous ne sommes pas pourvus de défensines, rien n’est meilleur pour la santé que de consommer du miel !
Il est d’usage d’agrémenter une bonne tisane d’une cuillère à soupe de miel pour soigner un vilain rhume. Loin d’être un reliquat de coutumes désuètes, ce geste est au contraire plein de bon sens ! En effet, il semblerait que le miel diminue l’adhérence des bactéries , les empêchant ainsi de se fixer et de proliférer. Ainsi, le miel aide à atténuer les maux de gorge et, dans le cas de toux sèches, à fluidifier le mucus.
Le miel : anti-vieillissement, anti-cancéreux
Le miel provient du pollen, extrêmement riche en flavonoïdes, tanins, et polyphénols, composés réputés pour leur propriétés antioxydantes, c’est-à-dire qu’ils aident à lutter contre le vieillissement cellulaire en contrant les dégénérescences génétiques induites par l’âge. Les substances citées se retrouvent dans le miel, qui, par conséquent, protégerait de nombreux cancers.
Le miel aide à cicatriser
Ce peut paraître étonnant, mais une cohorte de scientifiques étudient le miel pour ses propriétés cicatrisantes : déposé sur une plaie, le miel accélère grandement la cicatrisation des tissus. De nombreuses études l’ont démontré, cependant le mécanisme reste encore mystérieux. Reste que le miel, déjà utilisé dans certains hôpitaux, pourrait être la pommade cicatrisante de l’avenir…
Le miel : anticholestérolémiant
A l’heure où l’hypercholestérolémie est un problème de santé publique, le miel pourrait bien revenir en force. Contre ce fléau le miel est en effet doté de vertus anticholestérolémiantes.
Le miel actif dans la digestion
En plus de fournir de l’énergie, de lutter les bactéries et d’adoucir les maux de gorge, le miel agit également sur la sphère digestive ! Il possède des propriétés diurétiques, laxatives et aide à lutter contre les constipations passagères. Il serait également efficace contre les infections de l’estomac et de l’intestin.
Plus qu’un miel : la gelée royale
Le miel possède un analogue encore plus rare : la gelée royale. Aux reflets plus nacrés, la gelée royale est un miel de qualité supérieure produit par des abeilles ouvrières dites nourricières. Il permet à la reine d’une colonie, qui s’en nourrit exclusivement, de vivre jusqu’à quarante fois plus longtemps que ses congénères ! Même si cela n’est pas vrai chez l’homme, il n’en reste pas moins que la gelée, riche en protéines et en oligoéléments, est une source d’énergie formidable ! Pour l’anecdote scientifique, la gelée royale est seule à contenir de la royalactine, protéine impliquée dans la différenciation des abeilles au stade larvaire. Elle agit sur le récepteur aux hormones de croissance EGF, dont nous sommes également dotés ; mais n’ayez crainte : une cuillère de gelée royale ne transforme pas en reine des abeilles 😀

Le miel a une texture et des reflets exceptionnels. Le premier dictionnaire de l'Académie française (1964) définit l'abeille comme étant une mouche à miel !
Pour ses vertus médicinales incomparables, ou pour son goût exquis, que de bonnes raisons de manger régulièrement du miel !
Compléments sur les antibiotiques
Après m’être attardé sur la pénicilline contenue dans le roquefort, il est grand temps de dresser un portrait davantage exhaustif des antibiotiques. A l’usage des étudiants en médecine, ou des curieux bacheliers…
Les pénicillines font en fait partie des béta-lactamines, au même titre que les céphalosporines. Les béta-lactamines empêchent la synthèse de la paroi bactérienne, on ne le répétera jamais assez ! La bacitracine, la vancomycine et la teicoplanine sont les béta-lactamines les plus courants.
Concernant l’action sur la membrane plasmiques des bactéries, la polymyxine est un agent surfactant : elle agit comme un détergent en bousillant les lipides membranaires.
Pour ce qui est de l’action sur l’ADN bactérien, la mitomycine empêche sa réplication en bloquant la progression de l’ADN polymérase. L’actinomycine, elle, bloque la progression de l’ARN polymérase, empêchant ainsi la transcription de l’ADN en ARN messager.
Quant aux sulfamides, plus ancienne classe d’antibiotiques utilisés, ils se font passer pour l’acide para-aminobenzoïque, normalement utilisé par la bactérie pour produire la vitamine B9. Or cette vitamine est indispensable à la synthèse des précurseurs de l’ADN. Privées de vitamine B9, les bactéries meurent par carence en bases nucléiques. Les sulfamides inhibent la dihydroptéroate synthétase, enzyme menant à la formation des bases nucléiques, alors que la triméthoprime a un mode d’action un peu différent : elle inhibe la dihydrofolate réductase, second enzyme intervenant dans la biosynthèse des bases nucléiques (et catalysant la transformation de l’acide dihydrofolique en acide tétrahydrofolique). Le résultat est le même, me direz-vous…
Généralement, les sulfamides sont combinés aux diaminopyridines (sulfaméthoxazole + triméthoprime = cotrimoxazole) pour augmenter leur activité et réduire le risque d’émergence de résistance.
Ensuite, viennent les aminocoumarines, quinones, et fluoroquinolones, lesquelles s’attaquent à l’ADN gyrase, enzyme assurant l’enroulement de l’ADN. L’inhibition de cette activité est létale pour les bactéries. Les plus courants utilisés sont la novobiocine, l’acide nalidixique et la ciprofloxacine.
Enfin, vient la redoutable classe d’antibiotiques agissant au niveau des ribosomes bactériens, organite responsable de la synthèse des protéines. Parmi les aminosides, citons la streptomycines, la gentamycine et l’amikacine, lesquels se fixent sur la petite sous-unité des ribosomes.
On retrouve ensuite les phénicols, dont le chloramphénicol et le thiamphénicol : eux se fixent sur la grosse sous-unité des ribosomes, empêchant ainsi le bon déroulement de la traduction. N’ayez crainte : les phénicols ne s’attaquent qu’aux ribosomes bactériens, et non pas aux nôtres !

Les ribosomes traduisent le code génétique en protéine (les pièces de puzzle représentent des acides aminés). Pour peu que l'on les perturbe avec des antibiotiques, les bactéries meurent par carence en protéines.
Restent les cyclines, telles la tétracycline, la doxycycline, ou encore l’auréomycine, se fixant également sur la petite sous-unité ribosomale ; et enfin les macrolides (érythomycine, azithromycine), visant la grosse sous-unité du ribosome.
Petite dernière, la puromycine bloque l’extrêmité des ARN de transfert, empêchant ainsi l’élongation des protéines.
Et surtout, ne jamais oublier qu’un antibiotique peut détruire une bactérie ou seulement bloquer sa croissance (les globules blancs se chargeant du reste !). Dans le premier cas, on parle d’antibiotique bactéricide, et dans le second cas d’antibiotique bactériostatique. Pour clore sur une ouverture, il faut avoir en tête qu’en cas d’infection résistante, on dispose également d’antibiotiques moins spécifiques, c’est-à-dire pouvant s’attaquer dans une moindre mesure à nos cellules (mais sans danger durable étant donné le temps de prise). C’est le cas d’antibiotiques bloquant le cycle de Krebs, voie de biosynthèse de l’ATP. Comme chacun sait, l’ATP est le carburant de toute cellule : privées d’énergie, les bactéries dépérissent.
Contre la maladie, mangez du roquefort !
Une des grandes plaies de notre siècle est l’iatrogénèse médicamenteuse, à savoir les effets néfastes provoqués par la médecine (iatros signifie médecin en grec). On nous bassine assez avec la résistance aux antibiotiques induite par la surconsommation des médicaments. En effet, à force de prescrire des antibiotiques à tout-va, les microbes développent des stratégies de résistance aux médicaments. Face à cette antiobiorésistance, un comportement écocitoyen en vaut la chandelle : plutôt que de consulter pour une rhino-pharyngite, se soigner au roquefort ! De toute manière, il sera toujours temps d’aller voir le docteur si cela se complique…
Comment ça : le roquefort est un médicament ?
Non seulement le roquefort – ou plutôt ce qu’il renferme – est un antibiotique, mais c’est même l’un des plus puissants connus, si ce n’est le plus puissant. En fait, vous l’aurez remarqué, le roquefort – outre son bon lait de brebis – contient des moisissures. Loin d’être dégoûtantes comme on l’entend parfois, ces moisissures sont guérisseuses. L’une d’elle s’appelle Penicilium roqueforti : inoffensive pour l’Homme, ce champignon microscopique contenant de la pénicilline aide à lutter contre les infections bactériennes.
Un des médicaments les plus prescrits lors des infections hivernales est l’Augmentin, qui n’est rien d’autre qu’un concentré d’amoxicilline. Or l’amoxicilline est une pénicilline ! Vous ne rêvez pas : il existe plusieurs pénicillines, mais l’amoxicilline et la ticarcilline sont les plus courantes.
Le roquefort est donc une alternative efficace aux antibiotiques les plus courants. Un autre antibiotique, le Clamoxyl, a d’ailleurs pour nom générique amoxicilline ! On pourrait s’arrêter là, mais afin de ne pas mourir bête, tentons de comprendre pourquoi la pénicilline est si efficace contre les bactéries.
Qu’est-ce qui fait la supériorité de l’Augmentin ?
Malgré tout, pour ne rien vous cacher, l’Augmentin reste théoriquement plus efficace que le roquefort en raison de l’acide clavulanique qu’il contient en plus de la pénicilline. Il faut savoir que certaines bactéries se défendent contre la pénicilline à l’aide d’enzymes appelées bêta-lactamases. L’acide clavulanique, extrait de la bactérie Streptomyces clavuligerus, bloque cette enzyme, rétablissant ainsi l’efficacité de la pénicilline. Néanmoins, toutes les bactéries n’étant pas dotées de béta-lactamases, la pénicilline est souvent efficace administrée seule.
Comment ça marche la pénicilline ?
Mais au juste, comment fonctionne un antibiotique ? Nul besoin de connaissances particulières en biologie pour comprendre !
Une bactérie est une cellule : elle contient donc de l’ADN et une membrane, ainsi qu’une membrane renforçante appelée paroi. Pour les détruire, trois solutions s’offrent donc à nous :
– détruire l’ADN
– détruire la membrane plasmique
– détruire la paroi
La pénicilline est un antibiotique de la classe des béta-lactamines : elle s’oppose à la transpeptidation, étape primordiale de la biosynthèse de la paroi bactérienne. En effet, la paroi comporte des peptidoglycanes : si l’on empêche leur fabrication, la bactérie se meurt. Une autre classe d’antibiotiques, les glycopeptides, ont un effet similaire (pour la petite histoire, les glycopeptides sont inefficaces contre les bactéries gram-négatives car elles possèdent une membrane externe qui isole la paroi de l’extérieur, alors que les béta-lactamines n’ont pas de restriction d’efficacité !)
Mais on peut aussi perforer la paroi, à coup d’antibiotiques appelés polymixines. Ceci a pour effet d’ouvrir le cocon protecteur des bactéries, lesquelles meurent noyées.
On peut également détruire l’ADN, ou empêcher sa fabrication, grâce aux sulfamides et à la triméthoprime.
Il existe même deux autres modes d’action des antibiotiques :
– premièrement, empêcher la transcription d’ADN en ARN ; car il faut savoir que le code génétique – l’ADN – n’est pas directement utilisable pas les êtres vivants : les bactéries doivent le convertir en ARN. Si l’on empêche cette conversion, au moyen de rifamycines, alors les bactéries se trouvent piégées : elles ont de l’ADN, mais ne peuvent plus s’en servir pour fabriquer leur protéines.
– deuxièmement, on peut empêcher la traduction de l’ARN en protéines, au moyen d’antibiotiques appelés macrolides et aminosides (pour les plus téméraires, ceux-ci bloquent les sous-unités 50S et 30S des ribosomes). Privées de protéines, les bactéries meurent rapidement…
Attention cependant : la pénicilline n’est d’aucun secours contre les virus et champignons (« les antibiotiques, c’est pas automatique »). En cas d’infection virale ou fongique, seuls les médicaments s’avèrent efficaces ! Et dans tous les cas, en cas de syndromes persistants, rien ne vaut l’avis d’un médecin, car souvent, dans les infections résistantes, on prescrit plusieurs antibiotiques aux effets différents (l’union fait la force).
Malgré tout, sachez que la pénicilline n’est pas efficace contre toutes les bactéries, mais surtout contres celles dites gram-positives. Il existe un arsenal thérapeutique pour lutter contre les gram-négatives (polymixynes, sulfamides, etc.)
Petite parenthèse historique
On aurait pu commencer par là, mais il faut garder le meilleur pour la fin ! Depuis la plus haute Antiquité, l’utilisation des moisissures pour traiter des infections est connue. On savait, dans l’ancienne Chine, faire régresser des panaris à l’aide de peaux de fruits moisies. En Serbie, en Grèce, au Sri Lanka, les moisissures du pain s’utilisent depuis des temps immémoriaux. Pourtant, ce n’est qu’en 1928 que le célèbre Alexander Flemming découvre la pénicilline, et ce, par hasard ! Ses travaux sur les staphylocoques eurent sans doute été loin d’aboutir, si un champignon n’avait pas contaminé ses boites de pétri. Ce champignon provenait des cultures de son voisin de paillasse, un mycologue irlandais travaillant sur les allergies. Si ce genre de contamination n’est pas rare au début du siècle, Flemming eut le réflexe d’étudier tout-de-même ses boites au lieu de s’en débarrasser (en sciences on appelle cela un témoin) : c’est alors qu’il découvrit que les staphylocoques ne se développaient pas autour des champignons ! Il émit l’hypothèse que le champignon Penicillium notatum produisait un puissant antibiotique. Et il vit juste… Cette découverte lui valut le Prix Nobel. La pénicilline fut d’ailleurs le premier antibiotique identifié, peu avant les sulfamides, mis au point à partir de colorants. Elle fut longtemps l’arme la plus efficace pour lutter contre les bactéries. Mais à force d’en abuser, en 1945, 80 % des staphylocoques étaient sensibles à la pénicilline, alors qu’aujourd’hui, moins de 20 % le sont ! Les bactéries sont vivantes : elles apprennent à se défendre, et transmettent génétiquement ce savoir à leur descendance.
Morale de cette histoire : ne pas se priver de roquefort, et pas seulement quand on est malade ! Le roquefort est un alicament, contraction d’aliment et médicament. Pour peu qu’un germe soit en incubation, rien de tel q’une part de fromage en hiver pour se prémunir d’une grosse grippe !
Bien entendu, le roquefort n’est pas la panacée : ses cousins bleu d’Auvergne, fourme d’Ambert, Saint-Agur ou gorgonzola font aussi l’affaire. Plus généralement, tous les fromages à pâte persillée contiennent de la pénicilline.

Le roquefort fut, en 1925, le premier fromage à bénéficier d'une appellation d'origine. Aujourd'hui il comporte les labels d'origine certifiée (AOC) et protégée (AOP).
Vous savez désormais (presque) tout sur les antibiotiques ! Espérons que le roquefort soit votre allié redoutable dans la lutte contre les infections bactériennes… D’autant plus qu’il peut se prendre en complément d’un traitement médicamenteux (personne n’a encore jamais fait d’intoxication au roquefort !) Pour autant, sans s’attarder sur les vertus antibiotiques prodigieuses de l’huile de pépin de pamplemousse, gardons ce proverbe anglais en mémoire : « une pomme par jour éloigne le médecin » ! De même, une part de roquefort ne se refuse pas…
NB : de rares cas de chocs anaphylactiques dus à la pénicilline sont recensés, mais il n’y a pas plus de risque d’être allergique au roquefort qu’à autre chose ! Quand je vous dis qu’il n’y a aucune raison de s’en priver !















